/
Les molécules issues des organismes vivants ou biomolécules sont de plus en plus présentes dans les différents secteurs de l’économie (Scarsini et al., 2020).
Tant par la diversité des biomolécules qu’elles produisent que par la quantité de ces dernières, les organismes photosynthétiques sont des pourvoyeurs importants de biomolécules. Etant habituellement enfermées dans les cellules, les biomolécules doivent être extraites, séparées, purifiées avant utilisation.
/

/
De nombreuses méthodes d’extraction des biomolécules existent, elles sont généralement destructives pour la biomasse, ce qui génère des déchets chimiques auxquels peuvent s’ajouter des déchets biologiques, qui doivent être traités (Vinayak et al., 2015). Pour contourner ces difficultés, des méthodes d’extraction préservant la viabilité de la biomasse ont été mises au point, au cours de la première décennie du 21ème siècle et appliquée pour l’extraction des biomolécules de racines de plantes (Abadie, 2007) et de microalgues (Coustets et al., 2014, Hejaza and Wijffels, 2004).
Travaillant sur ce sujet depuis plusieurs années, l’équipe du professeur Benoît Schoefs de Le Mans Université a récemment mis au point une méthode d’extraction biocompatible basée sur l’utilisation d’impulsions électriques pour l’extraction des protéines de la microalgue verte d’eau douce Haematococcus pluvialis (Gateau et al., 2021 ; Figure 1).
/
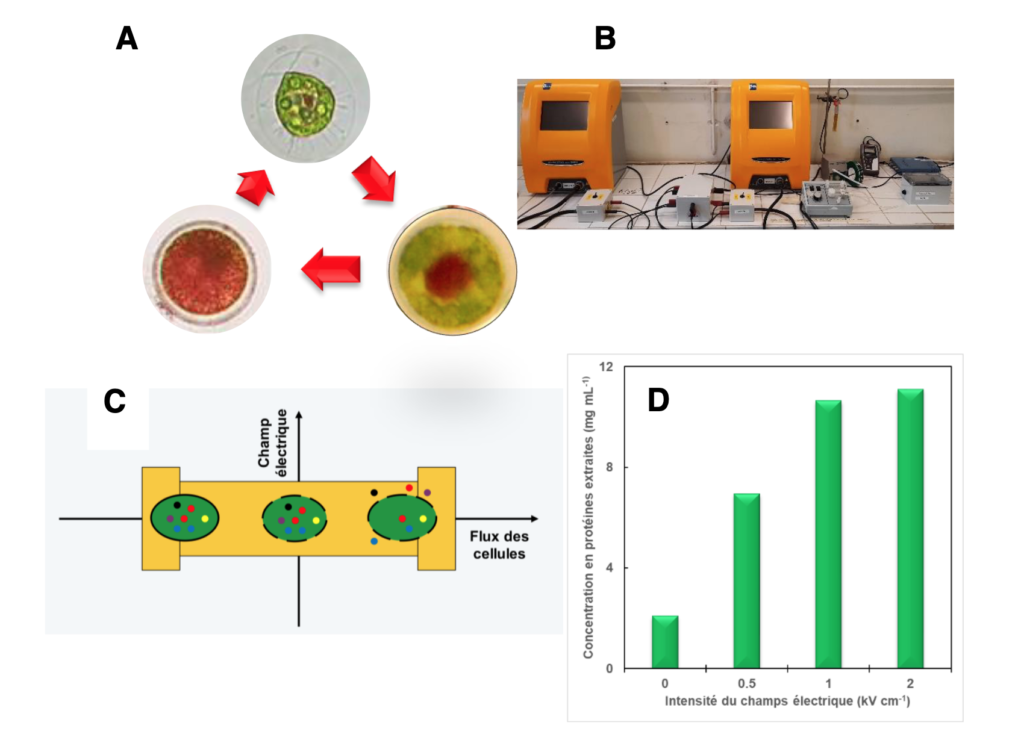
Figure 1 : l’extraction biocompatible des microalgues.
A. Les trois étapes principales du cycle de vie de la microalgue verte Haematococcus pluvialis. En absence de contrainte environnementale, la microalgue est verte et bi-flagellée. Lorsque les conditions de vie deviennent plus difficiles, le métabolisme est réorienté vers la production d’un caroténoïdes rouge l’astaxanthine, qui tend à s’accumuler. Lorsque ces conditions perdurent, la microalgue adopte une forme de résistance caractérisée par une paroi épaisse et un cytoplasme rempli d’astaxanthine.
B. Banc pour l’électroextraction des biomolécules. Il est composé d’un générateur et d’un co- générateur de l’impulsion électrique (en jaune) et d’une chambre de traitement (boitier de droite).
C. Principe de l’extraction biocompatible. Les microalgues (vert) sont enfermées dans une enveloppe (trait noir). Elles contiennent des biomolécules (disques colorés). Les microalgues sont entrainées dans la chambre de traitement (jaune) à l’aide d’une pompe péristaltique. Sous l’effet du champ électrique généré dans la chambre de traitement, des pores se forment dans l’enveloppe, laissant sortir les biomolécules dont les protéines. En mode biocompatible, le traitement électrique est suffisamment doux pour permettre aux pores de se refermer sans que la viabilité des cellules ne soit mise en péril, ouvrant ainsi la possibilité d’une extraction répétée.
D. Evolution de la quantité de protéines électroextraites en fonction de l’intensité du champ électrique utilisé. La quantité de protéines augmente jusque 2 kV cm-1 puis se stabilise (Gateau et al. 2021).
/
Selon les auteurs, 25% des protéines pourraient être extraites des cellules sans que la viabilité des cellules ne soit mise en péril. H. pluvialis, très connue pour sa production d‘un caroténoïde de couleur rouge appelé l’astaxanthine, est désormais également connue pour ses protéines (Figure 1). Parmi les 52 protéines électroextraites identifiées se trouve une enzyme intéressante pour l’industrie, la superoxyde dismutase. En outre la composition en acides aminés pourrait présenter un intérêt nutritionnel.
Consommant beaucoup moins d’énergie que les méthodes traditionnelles (Vinayak et al., 2015), l’utilisation des impulsions électriques pour l’extraction biocompatible (Figure 1) ouvre de nouvelles perspectives pour les biotechnologies végétales et en particulier pour l’extraction des protéines. Ce travail se poursuit actuellement en collaboration avec l’Université Dr Harising Gour à Sagar (Inde) et l’entreprise française Bioconcept Scientific dans le cadre d’un projet de recherche financé par le Centre Franco-Indien pour la Promotion de la Recherche Avancée (CEFIPRA). Il a pour but d’extraire de manière biocompatible des caroténoïdes de microalgues.
/
Références
▪ Abadie, J. 2007. La traite des plantes. La Recherche, 411, 50-52.
▪ Coustets, M., Joubert-Durigneux, V., Hérault, J., Schoefs, B., Blanckaert, V., Garnier, J.-P. & Teissié, J. 2014. Optimization of proteins electroextraction from microalgae by a flow process. Bioelectrochemistry, 103, 74-81.
▪ Gateau, H., Blanckaert, V., Veidl, B., Burlet-Schiltz, O., Pichereaux, C., Gargaros, A., Marchand, J. & Schoefs, B. 2021. Application of pulsed electric fields for the biocompatible extraction of proteins from the microalga Haematococcus pluvialis. Bioelectrochemistry, 137, 107588.
▪ Hejaza, M. A. & Wijffels, R. H. 2004. Milking of microalgae. Trends in Biotechnology, 22, 189-194.
▪ Scarsini, M., Marchand, J. & Schoefs, B. 2020. Carotenoid overproduction in microalgae: Biochemical and genetic engineering. In: Jacob-Lopes, E., Queiroz, M. I. & Zepka, L. Q. (eds.). Pigments from Microalgae Handbook. Cham: Springer International Publishing.
▪ Vinayak, V., Manoylov, K. M., Gateau, H., Blanckaert, V., Herault, J., Pencreac’h, G., Marchand, J., Gordon, R. & Schoefs, B. 2015. Diatom milking: a review and new approaches. Marine Drugs, 13, 2629-2665.
/
